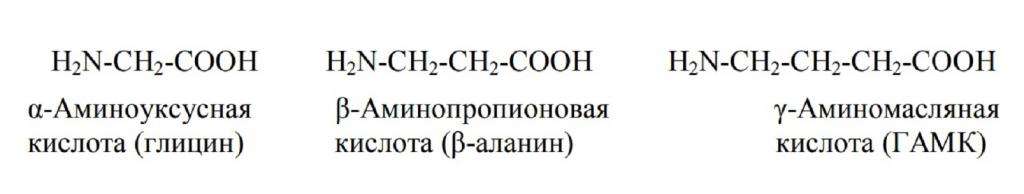что значит алифатические аминокислоты
Аминокислоты и биосинтез белка
АМИНОКИСЛОТЫ БЕЛКОВ
БИОСИНТЕЗ БЕЛКА НА РИБОСОМЕ
Известно более 200 природных аминокислот, которые можно классифицировать по-разному. Структурная классификация исходит из положения функциональных групп на альфа-, бета-, гамма- или дельта- положении аминокислоты.
Кроме этой классификации, существуют еще и другие, например, классификация по полярности, рН уровню, а также типу группы боковой цепи (алифатические, ациклические, ароматические аминокислоты, аминокислоты, содержащие гидроксил или серу, и т.д.).
В виде белков аминокислоты являются вторым (после воды) компонентом мышц, клеток и других тканей человеческого организма. Аминокислоты играют решающую роль в таких процессах, как транспорт нейротрансмиттеров и биосинтезе.
Общая структура аминокислот. Альфа аминокислоты. Изомеризация аминокислот.
Аминокислоты – биологически важные органические соединения, состоящие из аминогруппы (-NH2) и карбоновой кислоты (-СООН), и имеющие боковую цепь, специфичную для каждой аминокислоты. Ключевые элементы аминокислот – углерод, водород, кислород и азот. Прочие элементы находятся в боковой цепи определенных аминокислот.
В структуре аминокислот боковая цепь, специфичная для каждой аминокислоты, обозначается буквой R. Атом углерода, находящийся рядом с карбоксильной группой, называется альфа-углерод, и аминокислоты, боковая цепь которых связана с этим атомом, называются альфа-аминокислотами. Они представляют собой наиболее распространенную в природе форму аминокислот.
По свойствам боковых цепей аминокислоты подразделяются на четыре группы. Боковая цепь может делать аминокислоту слабой кислотой, слабым основанием, или эмульсоидом (если боковая цепь является полярной), или гидрофобным, плохо впитывающим воду, веществом (если боковая цепь неполярна).
АЛЬФА-АМИНОКИСЛОТЫ
Аминокислоты, имеющие как амин-, так и карбоксильную группу, прикрепляются к первому (альфа-) атому углерода имеют особое значение в биохимии. Они известны как 2-, альфа или альфа-аминокислоты (общая формула в большинстве случаев H2NCHRCOOH, где R представляет собой органический заместитель, известный как «боковая цепь»); часто термин «аминокислота» относится именно к ним.
Это 22 протеиногенных (то есть «служащих для строительства белка») аминокислоты, которые сочетаются в пептидные цепи («полипептиды»), обеспечивая построение широкого спектра белков. Они являются L-стереоизомерами («левыми» изомерами), хотя у некоторых бактерий и в некоторых антибиотиках встречаются некоторые из D-аминокислот («правых» изомеров).
Рис. 2. Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки. Разные аминокислоты, которые являются «строительными блоками» для белка, отличаются радикалом R.
ОПТИЧЕСКАЯ ИЗОМЕРИЯ АМИНОКИСЛОТ
Рис. 3. Оптические изомеры аминокислоты аланина
БИОСИНТЕЗ БЕЛКА НА РИБОСОМЕ
СТАНДАРТНЫЕ АМИНОКИСЛОТЫ
(протеиногенные)
Прим.: В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин и пирролизин. Это так называемые 21-я и 22-я аминокислоты.
Аминокислоты являются структурными соединениями (мономерами), из которых состоят белки. Они объединяются между собой, формируя короткие полимерные цепи, называемые пептидами длинной цепи, полипептидами или белками. Эти полимеры являются линейными и неразветвленными, каждая аминокислота в цепи присоединяется к двум соседним аминокислотам.
Рис. 5. Рибосома в процессе трансляции (синтеза белка)
Рис. 6 Стадии элонгации полипептида.
Двадцать две аминокислоты естественно включены в полипептиды и называются протеиногенными, или природными, аминокислотами. Из них 20 кодируются с помощью универсального генетического кода.
Белки имеют 4 уровня своей структурной организации: первичная, вторичная, третичная и четвертичная. Первичная структура — последовательность аминокислотных остатков в полипептидной цепи. Первичную структуру белка, как правило, описывают, используя однобуквенные или трёхбуквенные обозначения для аминокислотных остатков.Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями.Третичная структура — пространственное строение полипептидной цепи. Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. Четвертичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Рис. 8. Структурная организация белков
НЕСТАНДАРТНЫЕ АМИНОКИСЛОТЫ
(Не-протеиногенные)
Функции аминокислот
БЕЛКОВЫЕ И НЕ БЕЛКОВЫЕ ФУНКЦИИ
Из-за своей биологической значимости аминокислоты играют важную роль в питании и обычно используются в пищевых добавках, удобрениях и пищевых технологиях. В промышленности аминокислоты используются при производстве лекарств, биоразлагаемого пластика и хиральных катализаторов.
1. Аминокислоты, белки и питание
О биологической роли и последствиях дефицита аминокислот в организме человека см. информацию в таблицах незаменимых и заменимых аминокислот.
При введении в организм человека с пищей, 20 стандартных аминокислот либо используются для синтеза белков и других биомолекул, либо окисляются в мочевину и углекислый газ в качестве источника энергии. Окисление начинается с удаления аминогруппы через трансаминазу, а затем аминогруппа включается в цикл мочевины. Другой продукт трансамидирования – кетокислота, которая входит в цикл лимонной кислоты. Глюкогенные аминокислоты также могут быть преобразованы в глюкозу посредством глюконеогенеза.
БЕЛКИ
Рис. 9. Белки не только пища. Типы белковых соединений.
Каждый живой организм состоит из белков. Различные формы белков принимают участие во всех процессах, происходящих в живых организмах. В теле человека из белков формируются мышцы, связки, сухожилия, все органы и железы, волосы, ногти; белки входят в состав жидкостей и костей. Ферменты и гормоны, катализирующие и регулирующие все процессы в организме, также являются белками. Дефицит белков в организме опасен для здоровья. Каждый белок уникален и существует для специальных целей.
ПИТАНИЕ И БЕЛКИ
Белки — важная часть питания животных и человека (основные источники: мясо, птица, рыба, молоко, орехи, бобовые, зерновые; в меньшей степени: овощи, фрукты, ягоды и грибы), поскольку в их организмах не могут синтезироваться все необходимые аминокислоты и часть должна поступать с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются для биосинтеза собственных белков организма или подвергаются дальнейшему распаду для получения энергии.
Стоит подчеркнть, что современная наука о питании утверждает, что белок должен удовлетворять потребности организма в аминокислотах не только по количеству. Данные вещества должны поступать в организм человека в определенных соотношениях между собой.
2. Небелковые функции аминокислот
Нейромедиатор аминокислоты

В организме человека многие аминокислоты используются для синтеза других молекул, например:
Тем не менее, все еще известны не все функции других многочисленных нестандартных аминокислот. Некоторые нестандартные аминокислоты используются растениями для защиты от травоядных животных. Например, канаванин является аналогом аргинина, который содержится во многих бобовых, и в особо крупных количествах в Canavalia gladiata (канавалия мечевидная). Эта аминокислота защищает растения от хищников, например насекомых, и при употреблении некоторых необработанных бобовых может вызывать заболевания у людей.
Классификация протеиногенных аминокислот
Рассмотрим классификацию на примере 20 протеиногенных α-аминокислот, необходимых для синтеза белка
Среди многообразия аминокислот только 20 участвует во внутриклеточном синтезе белков (протеиногенные аминокислоты). Также в организме человека обнаружено еще около 40 непротеиногенных аминокислот. Все протеиногенные аминокислоты являются α-аминокислотами. На их примере можно показать дополнительные способы классификации. Названия аминокислот обычно сокращаются до 3-х буквенного обозначения (см. рис. полипептидной цепи вверху страницы). Профессионалы в молекулярной биологии также используют однобуквенные символы для каждой аминокислоты.
1. По строению бокового радикала выделяют:
Ароматические соединения (арены)
— циклические органические соединения, которые имеют в своём составе ароматическую систему. Основными отличительными свойствами являются повышенная устойчивость ароматической системы и, несмотря на ненасыщенность, склонность к реакциям замещения, а не присоединения.
Различают бензоидные (арены и структурные производные аренов, содержат бензольные ядра) и небензоидные (все остальные) ароматические соединения.
Ароматичность — особое свойство некоторых химических соединений, благодаря которому сопряженное кольцо ненасыщенных связей проявляет аномально высокую стабильность;
2. По полярности бокового радикала
Существуют неполярные аминокислоты (ароматические, алифатические) и полярные (незаряженные, отрицательно и положительно заряженные).
3. По кислотно-основным свойствам
По кислотно-основным свойствам подразделяют нейтральные (большинство), кислые (аспарагиновая и глутаминовая кислоты) и основные (лизин, аргинин, гистидин) аминокислоты.
4. По незаменимости
По необходимости для организма выделяют такие, которые не синтезируются в организме и должны поступать с пищей – незаменимые аминокислоты (лейцин, изолейцин, валин, фенилаланин, триптофан, треонин, лизин, метионин). К заменимым относят такие аминокислоты, углеродный скелет которых образуется в реакциях метаболизма и способен каким-либо образом получить аминогруппу с образованием сответствующей аминокислоты. Две аминокислоты являются условно незаменимыми (аргинин, гистидин), т.е.их синтез происходит в недостаточном количестве, особенно это касается детей.
Алифатическая аминокислота: что это?
Алифатическая аминокислота – что это?
Аминокислоты выполняют важные функции в организме человека и других животных, так как являются нейромедиаторами и «кирпичиками» для построения белков. Также они нужны для правильного обмена веществ.
Алифатические аминокислоты – это разновидность аминокарбоновых аминокислот, у которых амино- и карбоксильная группы связаны с алифатическим атомом углерода. Термин «алифатический» подразумевает линейные или разветвленные цепи из атомов данного элемента.
Основная масса аминокислот, которые были выделены из живых организмов, относятся именно к алифатическим. В химии используют, в основном, обиходные названия этих веществ по исходным белкам, из которых они были получены, так как по систематической номенклатуре у них слишком громоздкие наименования.
Типы соединений по строению
Алифатические аминокислоты, в зависимости от положения амино- и карбоксильных групп, подразделяют на следующие виды:
Альфа-изомеры. К ним относится основная масса природных соединений, которые находятся в растениях, микроорганизмах, животных. Их находят также в метеоритах, причем структура этих веществ такая же, как и у земных живых существ.
Бетта-аминокислоты. Примером является β-аланин, который служит частью кофермента А. Последний принимает участие в синтезе и окислении жирных кислот.
Гамма-изомеры. Один из ярких представителей этой группы – ɣ-аминомасляная кислота (ГАМК), важнейший нейромедиатор нервной системы, отвечающий за торможение нервных процессов, ослабление и подавление возбуждения.
Все аминокислоты альфа-типа, кроме глицина, имеют асимметричную структуру, существуют в виде двух зеркальных, не совмещаемых в пространстве отражений (L- и D-аминокислоты) и обладают естественной оптической активностью. Важнейшими L-аминокислотами являются глицин, аланин, серин, цистеин, аспарагиновая кислота, тирозин, лейцин, глутамин, изолейцин, аргинин, лизин, пролин.
Примеры алифатических аминокислот приведены на рисунке ниже.
Виды веществ по другим критериям
Существует также классификация по характеру участия алифатических аминокислот в синтезе белка.
Протеиногенные соединения из L-ряда, которые присоединяются в состав белков в рибосомах под контролем РНК. Их последовательность кодируется генетически. Таких аминокислот всего двадцать.
Непротеиногенные (некодируемые), не входящие в состав белков, но выполняющие важные функции (в основном, участие в обменных процессах). Некоторые из них являются токсинами и ядовиты для человека.
По кислотно-основным свойствам алифатические аминокислоты подразделяют на 3 типа:
кислые (аспарагиновая и глутаминовая кислоты);
нейтральные, содержащие одно и то же число основных и кислотных групп;
основные (гистидин, аргинин, лизин и другие).
Физико-химические характеристики
Для алифатических аминокислот характерны следующие свойства:
структура в виде биполярных ионов в кристаллическом состоянии;
высокая температура плавления (у α-аминокислот нет ее четкого значения);
хорошая растворимость в воде и водных растворах щелочей, кислот;
основные свойства в кислой среде и наоборот;
если pH среды больше, чем изоэлектрическая точка, то алифатические аминокислоты образуют с щелочами соли, которые хорошо растворяются в воде.
Из смесей этих веществ с их натриевыми или калиевыми солями делают буферные растворы, применяемые для химического анализа.
Синтез
В лабораторных условиях производство данных соединений представляет собой сложную задачу, так как они являются оптически активными, и в естественных условиях их выработка происходит с участием ферментов. Поэтому химическим путем получают только рацемические аминокислоты, представляющие собой смесь оптических изомеров.
В качестве исходного вещества применяют α-галоидкарбоновые кислоты, которые при реагировании с аммиаком дают алифатические аминокислоты. Существуют и другие способы получения – из кетокислот и их производных в процессе восстановительного аминирования, из малонового эфира, аминоуксусной кислоты (глицина). Для синтеза аминокислот в промышленном масштабе используют микробиологические технологии. При помощи генной инженерии эти вещества выделяют из белковых молекул, вырабатываемых специально культивируемыми микроорганизмами.
Роль в природе
Только в растениях и микроорганизмах выявлено более 200 алифатических аминокислот, а всего их насчитывается на сегодняшний день свыше пятисот. Они входят в состав антибактериальных веществ (например, пенициллина), которые вырабатывают микроорганизмы, а также формируют клеточные стенки большинства бактерий.
В организме животных эти вещества выполняют следующие основные функции:
синтез белков, ферментов, гормонов, коэнзимов и других важных органических соединений;
образование биологически активных аминов (дофамин, норадреналин, адреналин, серотонин и других);
участие в передаче нервных импульсов и в метаболических процессах.
В клетках головного мозга человека происходит активный обмен веществ с участием аминокислот, концентрация которых превосходит в 7 раз таковую в плазме крови.
Применение в медицине
Использование этих соединений в лечебных целях основано на их свойстве участвовать в обмене азотистых элементов и синтезе биологически активных веществ. Существует множество препаратов, где содержатся алифатические аминокислоты. Ниже перечислены некоторые из них и их назначение в терапевтической практике.
Глутаминовая кислота – патологии ЦНС, эпилепсия, психозы, задержка психического развития у детей, ДЦП, болезнь Дауна.
Метионин – токсические поражения печени (цирроз, отравления мышьяком, хлороформом и другими токсинами), а также заболевания этого органа при хроническом алкоголизме, сахарном диабете.
Аминалон – нейротропное средство.
Цистеин – при катаракте.
Ацетилцистеин – при заболеваниях органов дыхания в качестве муколитика.
Что значит алифатические аминокислоты
Рассмотрена биологическая роль алифатических аминокислот линейного строения для организма человека и произведен комплексный анализ коллигативных и вязкостных характеристик водных растворов указанных аминокислот. Показана актуальность исследования данных характеристик, поскольку многокомпонентные растворы аминокислот используются в медицине и фармации в виде инфузионных растворов в качестве источников для парентерального питания, а к данным лекарственным формам предъявляются требования изотоничности и изовязкости крови человека. Водные растворы индивидуальных аминокислот (глицина, α-аланина, ε-аминокапроновой кислоты, глутаминовой кислоты) характеризуются линейным изменением коллигативных и вязкостных свойств с ростом концентрации вплоть до достижения предела растворимости. Определены уравнения линейной регрессии соответствующих зависимостей. По величинам коэффициентов корреляции Пирсона доказано существование достоверной корреляционной связи между концентрацией аминокислот и температурами замерзания растворов, осмотическим давлением, кинематической, динамической и относительной вязкостью.
Аминокислоты как основные составные части белков участвуют во всех жизненных процессах наряду с нуклеиновыми кислотами, углеводами и липидами. При попадании в живой организм аминокислоты сразу же включаются в биохимические процессы [8]. Биохимические процессы, как химические реакции, сопровождаются изменением общей энергии системы, т.е. энергии живого организма. Функции аминокислот в системах живых организмов схематично показаны на рис. 1. Большинство α-аминокислот обладают широким спектром биологической активности. Так, лизин, треонин, фенилаланин, тирозин, аспарагин, глутамин, глицин, серин, аргинин являются исходными веществами для синтеза антител, гормонов, ферментов и других веществ. Аланин участвует в метаболизме сахаров и органических кислот. Метионин, триптофан, лизин, аргинин способствуют снижению уровня холестерина в крови, выведению тяжелых металлов из организма (метионин, цистеин), росту и восстановлению тканей (гистидин, изолейцин, лейцин, глицин, серин, пролин). α-Аминокислоты служат источником энергии на клеточном уровне (валин, лейцин, изолейцин, глутамин). Серосодержащие аминокислоты – метионин, цистеин – являются донорами серы, достаточное содержание которой в организме способствует полноценному формированию волос, кожи и ногтей. Эти аминокислоты принимают участие в создании вторичной структуры белков за счет образования дисульфидных мостиков [8].
Рассмотрим биологическую роль алифатических аминокислот линейного строения – глицина, β-аланина и ε-аминокапроновой кислоты – для организма человека. Глицину принадлежит важнейшая роль в деятельности мозга, поскольку глицин участвует в образовании важнейших биологически активных соединений (пуриновых нуклеотидов, гема, креатина и др). Глицин выполняет функцию тормозного нейромедиатора и контролирует процессы формирования тонкой моторики пластических процессов и тонусных реакций поперечнополосатой мускулатуры. Поэтому в неврологической практике глицин широко используется для устранения повышенного мышечного тонуса [1]. В организме человека основная масса глицина сконцентрирована в спинном мозге. Глицин является регулятором обмена веществ, нормализует и активирует процессы защитного торможения в центральной нервной системе. Глицин обладает адреноблокирующим, антиоксидантным и антитоксическим действием, за счет чего уменьшает психоэмоциональное напряжение, агрессивность, конфликтность, улучшает настроение, повышает социальную адаптацию; повышает умственную работоспособность; облегчает засыпание и нормализует сон; уменьшает проявления вегетососудистых расстройств в целом и выраженность общемозговых расстройств при ишемическом инсульте и черепно-мозговых травмах; уменьшает токсическое действие алкоголя и других лекарственных средств, угнетающих функцию центральной нервной системы.
Рис. 1. Функции аминокислот в живом организме
Аминокислота β-аланин синтезируется в организме человека, поэтому не является незаменимой. Биологическая роль β-аланина заключается в его участии в синтезе пантотеновой кислоты (витамина В5), которая необходима для синтеза ацилкоэнзима А. В свою очередь ацилкоэнзим А необходим для ферментов цикла карбоновых кислот (цикл Кребса) и жизненно необходим для синтеза основного субстрата энергетического метаболизма – аденозинтрифосфата АТФ. β-Аланин участвует нормализации терморегуляции и способствует стабилизации энергетического метаболизма за счет увеличения содержания пантотеновой кислоты, является важнейшим координатором фонда возбуждающих и тормозных нейромедиаторов, повышает дыхательную активность нейроцитов, ускоряет утилизацию глюкозы и улучшает кровообращение. β-аланин широко используется в медицинской практике для лечения мигреней, цереброваскулярной недостаточности и других заболеваний нервной системы, связанных с нарушением кровообращения [1, 2, 8]. Данная аминокислота обладает выраженным диуретическим действием и при этом выгодно отличается от классических диуретических средств, так как не требует коррекции электролитов [1].
ε-аминокапроновая кислота не входит в перечень 20-ти аминокислот, из которых построены белки организма человека. При этом ε-аминокапроновая кислота проявляет выраженную биологическую активность, которая для организма человека заключается в активизации детоксикационной функции печени, проявлении противоаллергического действия, в специфическом кровоостанавливающем действии при кровотечениях (обеспечивает стабилизацию фибрина и его отложение в сосудистом русле, способствует агрегации тромбоцитов и эритроцитов крови).
Живые организмы, в том числе и человеческий организм, характеризуются высоким содержанием воды. При протекании биохимических процессов происходит расходование реагентов и образование продуктов реакции, поэтому любая биохимическая реакция сопровождается изменением концентрации целого набора веществ, а значит, возможны изменения осмотических характеристик и вязкостных свойств биологических жидкостей [3-7, 10, 12]. Из литературных данных [10] известно, что структура биологических жидкостей характеризуется наличием дальнего порядка, т.е. помимо согласованного взаимного расположения и ориентации близко расположенных групп и сегментов молекул (ближний порядок) проявляется согласованное действие молекул определенного функционального назначения. При этом молекулы биологических жидкостей не только перемещаются на определенные расстояния, но и принимают необходимую пространственную ориентацию [10]. Это в свою очередь также находит отражение на коллигативных и вязкостных характеристиках биологических жидкостей.
Биологические объекты – аминокислоты, белки, пептиды – являются сырьем для производства лекарственных препаратов: препараты крови и плазмы крови, препараты, содержащие определенный набор аминокислот, биологически активные добавки, включающие лецитин, витамины, ферменты, энзимы и т.д. Препараты аминокислот широко представлены как в ассортименте пищевых и биологически активных добавок, так и в ассортименте лекарственных веществ. Комплексными препаратами аминокислот являются инфузионные растворы («Аминостерил», «Аминоплазмаль», «Инфезол», «Ликвамин» и т.д.) или сухие смеси для спортивного питания. Индивидуальные аминокислоты входят в состав таблеток («Глицин Форте», «Клималанин» и т.д.), глазных капель («Тауфон»), растворов для инъекций («Тауфон», «Карнитен»), порошков («Левокарнитин», «Треонин», «Цистин» и т.д.).
В связи с этим целью данного исследования является обобщение и комплексный анализ коллигативных и вязкостных характеристик водных растворов аминокислот линейного строения.
Материалы и методы исследования
В качестве объекта исследования использовали водные растворы аминокислот: глицина, β-аланина, ε-аминокапроновой кислоты и глутаминовой кислоты. Определение температуры замерзания проводили на автоматическом криоскопическом осмометре ОМТ–5–02. Предварительно прибор калибровали с помощью серии растворов рабочих стандартных образцов натрия хлорида. Испытуемые растворы различной концентрации помещали в кювету прибора, погружали в термостат с контролируемой температурой и замораживали. Осмолярность раствора автоматически определяется по фиксированной температуре замерзания.
Определение вязкости термостатированных при 25оС растворов аминокислот проводили при помощи вискозиметра ВПЖ-2, диаметр капилляра 0,73 мм, константа капилляра 0,03045.
Обсуждение результатов
Охарактеризовать свойства растворов веществ с точки зрения их совместного присутствия позволяет криоскопический метод. При замораживании растворов оценивается изменение температуры замерзания раствора по сравнению с чистым растворителем, эффективная осмотическая концентрация растворенного вещества и осмотическое давление. Эти показатели, отражающие коллигативные свойства растворов, являются одними из важнейших для систем, применяемых для парентерального введения [1, 2].
Коллигативные свойства растворов в целом определяются общей концентрацией осмотически активных частиц. Проанализируем, как изменяется число частиц в водном растворе, содержащем аминокислоту. Молекулы аминокислот имеют в своем составе карбоксильную группу и аминогруппу, а поэтому являются амфолитами [8]. Диссоциация карбоксильной группы и протонирование аминогруппы протекает в соответствии с уравнениями:
Возможен перескок протона от карбоксильной группы к аминогруппе и образование биполярного цвиттер-иона в соответствии с уравнением:

Сила молекул аминокислот как кислот и как оснований характеризуется константами диссоциации 6. Константы диссоциации глицина, β-аланина и ε-аминокапроновой кислоты по типу кислоты или основания составляют величины порядка 10-10 – 10-11 независимо от расположения аминогруппы. Значения констант диссоциации очень малы, а, значит, диссоциация карбоксильной группы и/или протонирование аминогруппы в водных растворах протекают крайне незначительно. Реакция образования цвиттер-иона не сопровождается увеличением числа частиц. Изучение осмотических характеристик растворов глицина и β-аланина показывает, что эффективная осмотическая концентрация частиц, выраженная в единицах молярности, практически совпадает с аналитически рассчитанной молярной концентрацией аминокислот 6. Значит, увеличения числа частиц в растворе не происходит, и при анализе осмотических характеристик растворов данных аминокислот не нужно учитывать процессы, изменяющие число частиц (диссоциацию, протонирование или образование ионных ассоциатов). Аналогичные результаты получены для глутаминовой кислоты, которая является двухосновной аминокислотой линейного строения и имеет существенно меньшую растворимость в воде и существенно бoльшую константу диссоциации одной из карбоксильных групп (Ка1=3,09·10-5) [8]. Экспериментально установлено, что для индивидуальных аминокислот в водных растворах характерно линейное понижение температуры замерзания и линейное увеличение осмотического давления с ростом концентрации аминокислоты вплоть до достижения предела растворимости (рис. 1, 2). Двухкомпонентные смеси низкомолекулярных аминокислот проявляют коллигативные свойства, аналогичные индивидуальным аминокислотам, т.е. сохраняется тенденция линейного изменения температуры замерзания растворов и осмотического давления с коэффициентами корреляции не ниже 0,99.
Уравнения линейной аппроксимации и коэффициенты корреляции для вязкости глицина, β-аланина и ε-аминокапроновой кислоты.