таблица менделеева красивая в хорошем качестве
Картинки таблица Менделеева (47 фото)
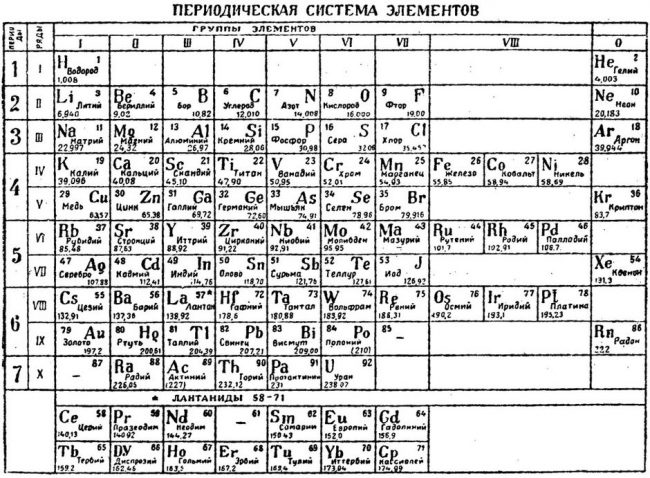
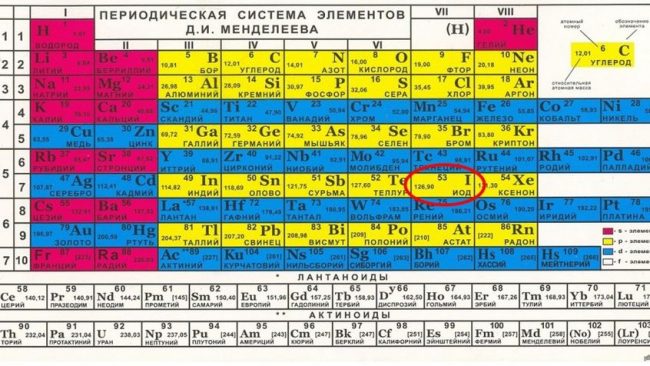
Известная сегодня каждому школьнику таблица Менделеева была представлена миру в 1869 году. Основой для расположения химических элементов послужил заряд атомного ядра. Таким образом благодаря таблице Менделеева стало легко распределять атомы на группы с определенными качествами. И естественно она дала огромный толчок среди многих областей науки. Представляем вам красивые картинки про таблицу Менделеева, которые тут можно посмотреть.
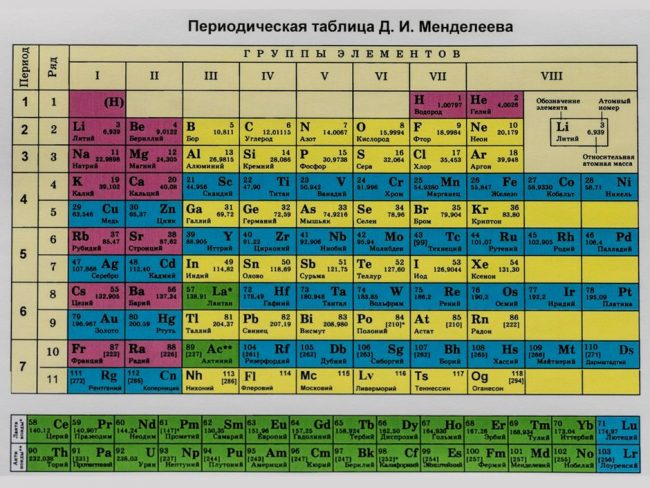
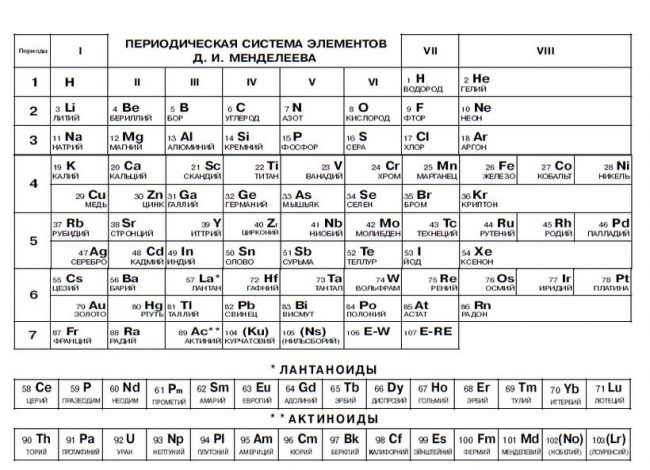
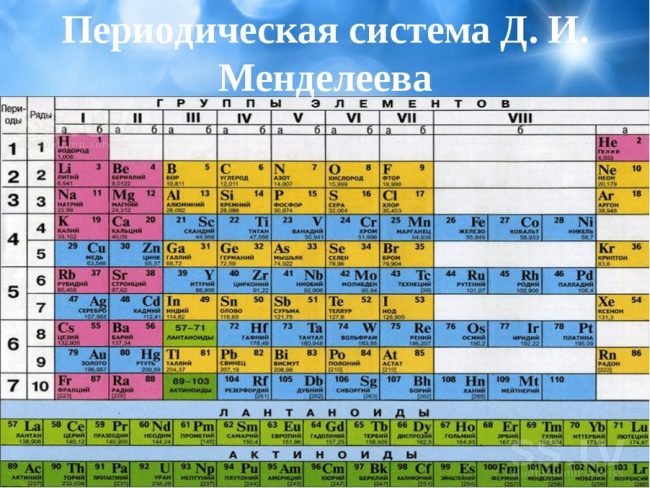
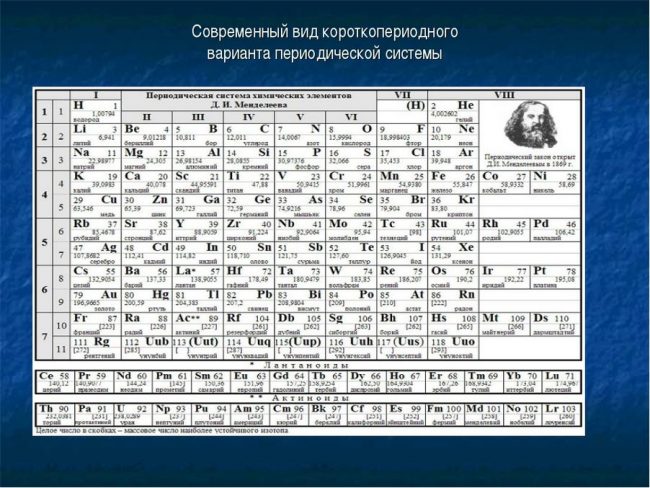
Периодическая система элементов.
Таблица Менделеева на темном фоне.
Ячейка для каждого элемента.
Лантаноиды и актиноиды.
Картинка таблицы Менделеева.
Популярная классификация химических элементов.
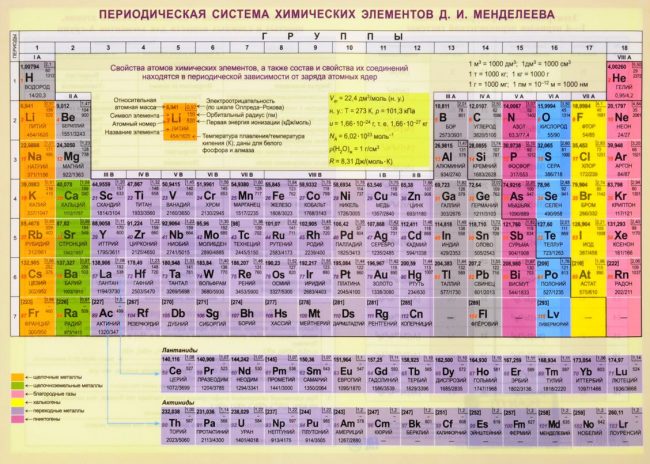
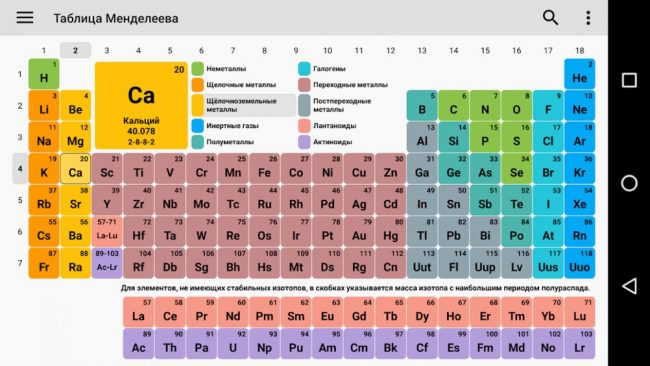
Таблица Менделеева в цвете.
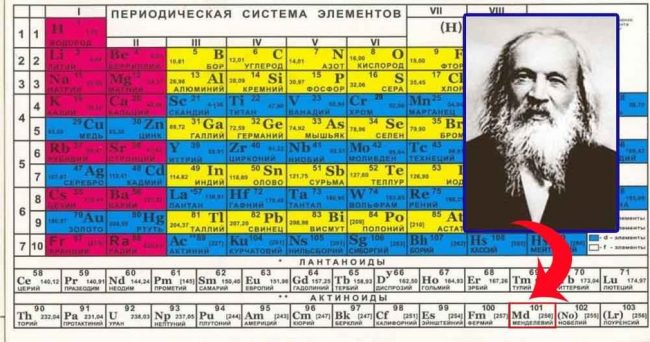
Портрет в правом верхнем углу.
Пронумерованные строки с элементами.
Памятка для уроков по химии.
Черно-белая структура химических элементов.
Прикольная картинка таблицы Менделеева.
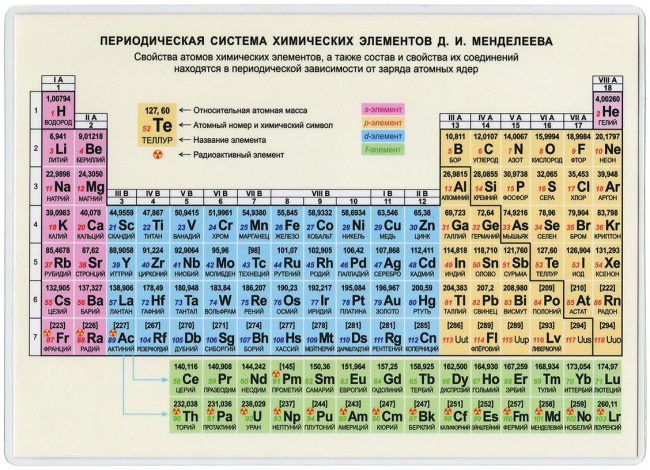
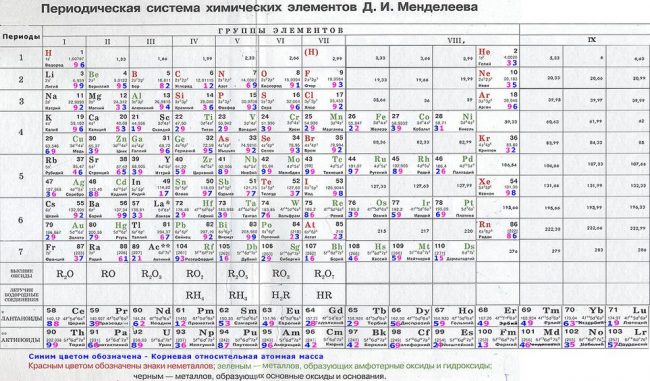
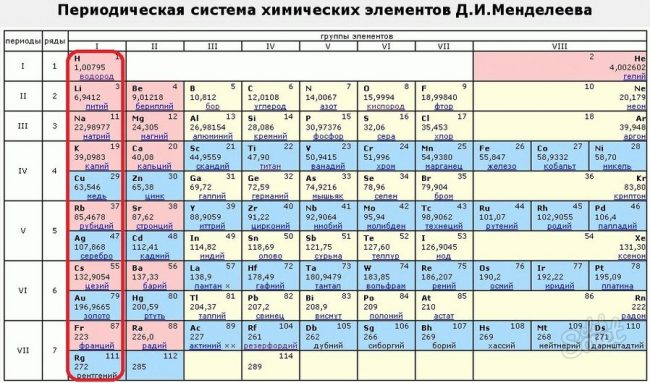
Периодическая система химических элементов.
Работа известного химика.
Распределение элементов по группам.
Таблица Менделеева на обгорелом листе.
Литий, бериллий, висмут.
Элементы на экране телефона.
Красивая картинка таблицы Менделеева.
Сортировка элементов по группам.
Незаменимая таблица Менделеева.
Символ и порядковый номер элемента.
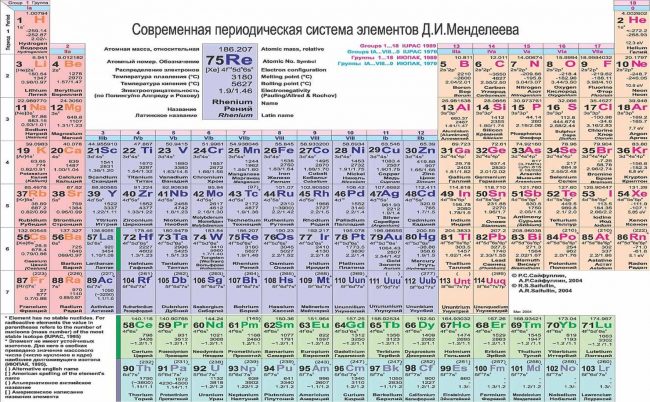
Разные цвета групп.
Таблица Менделеева на картинке.
Розовый фон для элементов.
Периодическая система атомов.
Таблица Менделеева с фотографией.
Изотопы в качестве исключений.
Элементы красивыми цветами.
Интересная таблица Менделеева.
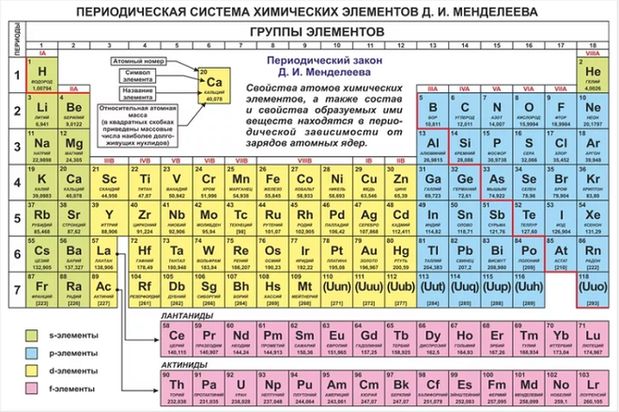
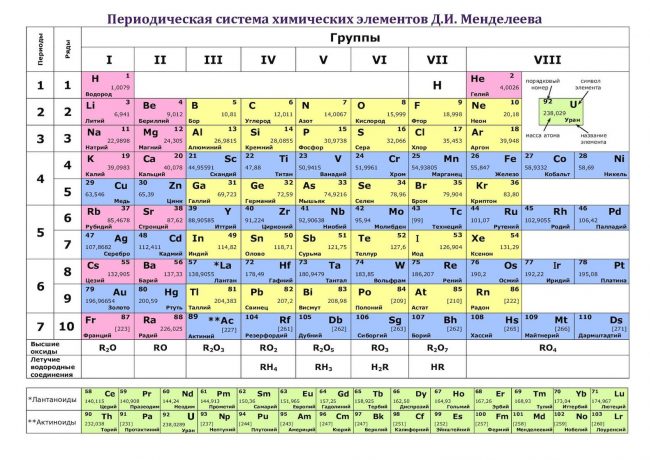
Периодическая система химических элементов.
Атомы обведены красными рамками.
Актиноиды рядом с Лантаноидами.
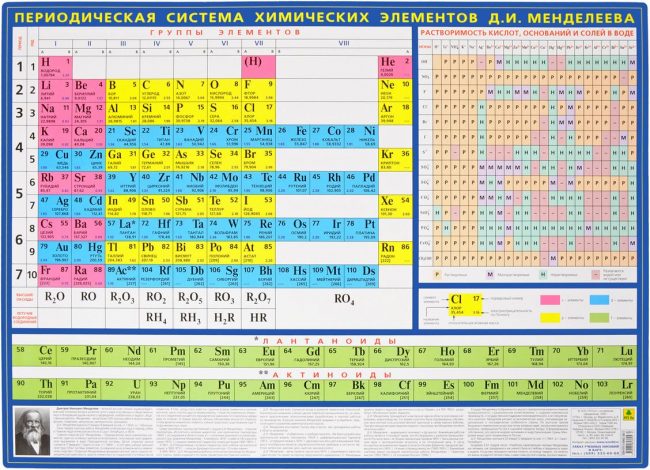
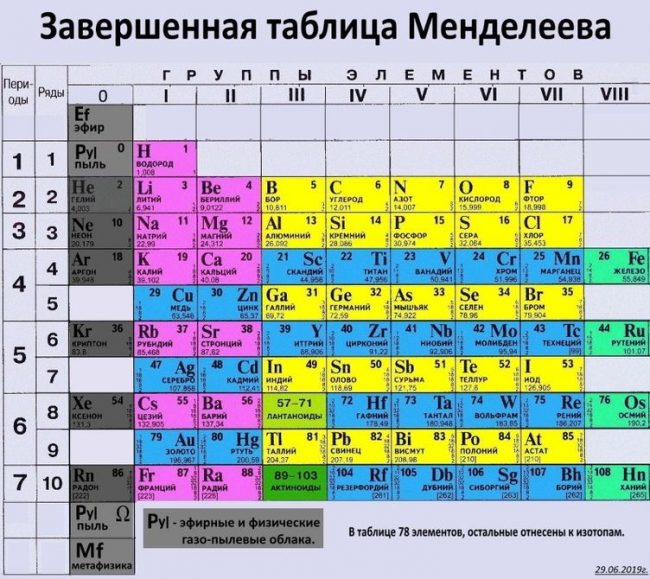
Упрощенная таблица Менделеева.
Портрет великого ученого.
Система химических элементов.
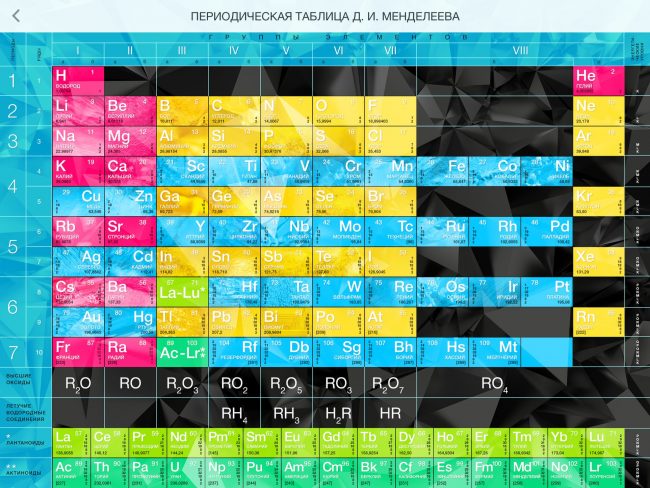
Современная таблица Менделеева.
Пояснение в правом верхнем углу.
Номера колонок римскими цифрами.
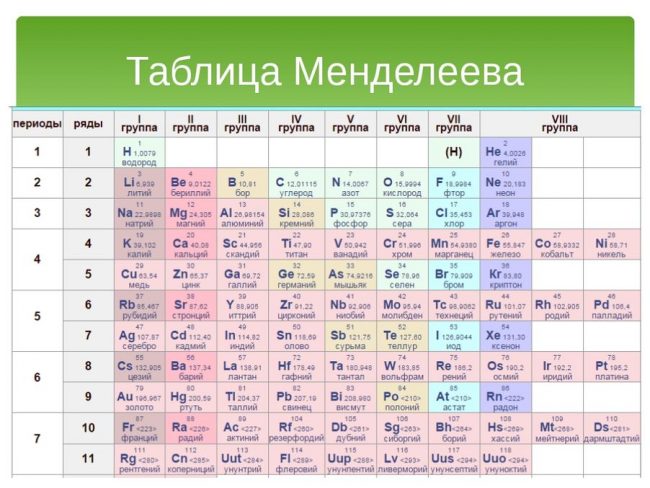
Группы элементов таблицы Менделеева.
Периодическая система химических элементов.
ТАБЛИЦА МЕНДЕЛЕЕВА

Чтобы посмотреть все свойства конкретного химического элемента нужно перейти по ссылке нажав на символ элемента в таблице.
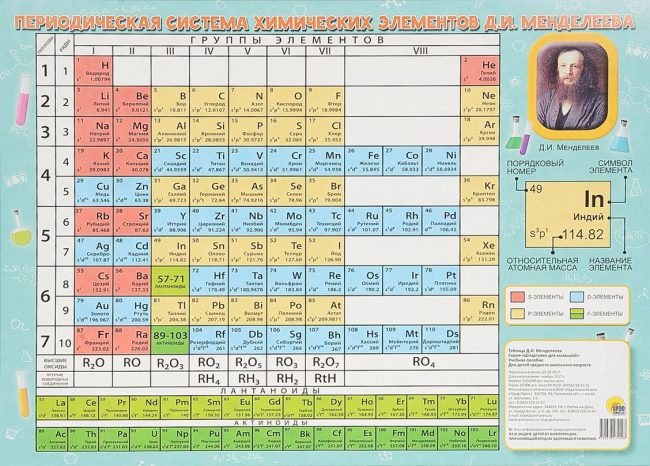
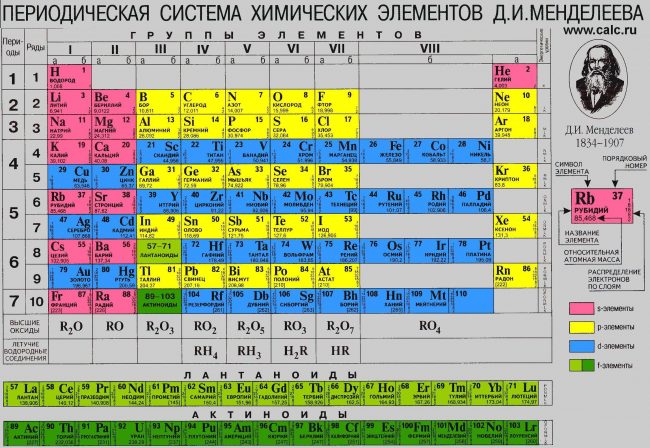
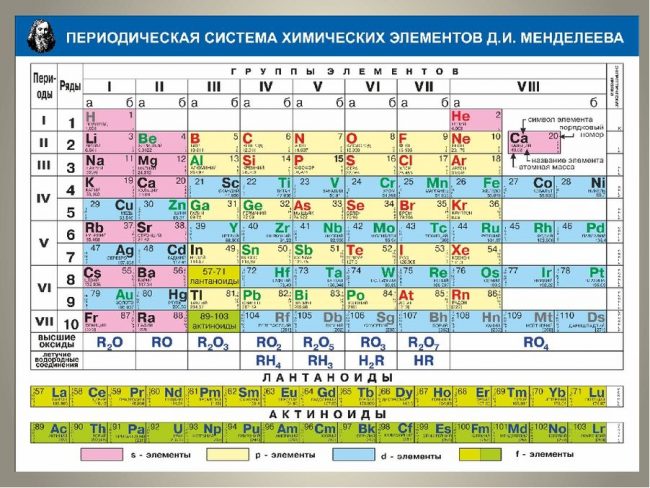
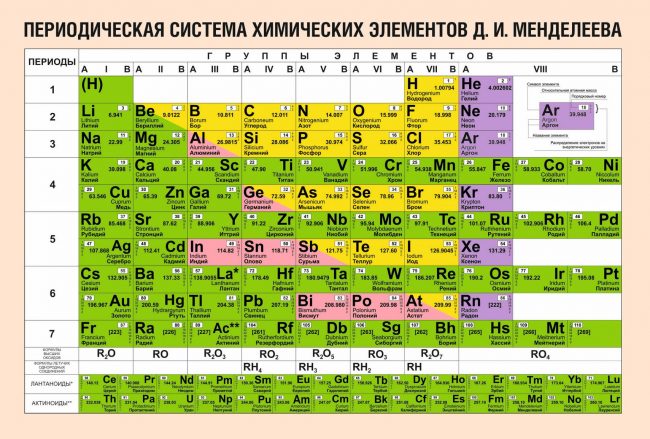
Периодическая система химических элементов Д.И. Менделеева
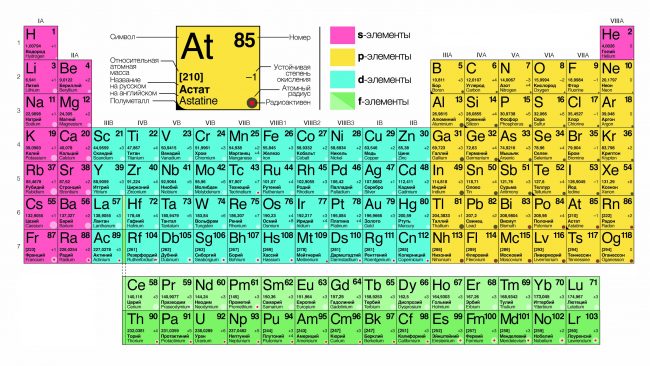
Расшифровка периодической системы химических элементов Д.И. Менделеева:
Число элементов в периоде – максимальная емкость соответствующего энергетического уровня:
18 элементов (5s 2 4d 10 5p 6 )
8 элементов (2s 2 2p 6 )
32 элемента (6s 2 4f 14 5d 10 6p 6 )
8 элементов (3s 2 3p 6 )
32 элемента (6s 2 4f 14 5d 10 6p 6 )
18 элементов (4s 2 3d 10 4p 6 )
Построение периодов – в начале: два s-элемента, в конце: шесть р- элементов. В четвертом и пятом периодах между ними помещается по десять d-элементов, а в шестом и седьмом к ним добавляются четырнадцать f-элементов (формы электронных орбиталей).
В периоде – свойства химических элементов различаются между собой, т.к. электронные конфигурации валентных электронов их атомов различны.
В подгруппе – свойства элементов сходны между собой, т.к. электронные конфигурации валентных электронов их атомов сходны.
Причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций внешних энергетических уровней.
Формы электронных орбиталей (электронные семейства)
Классификация химических элементов по электронным конфигурациям их атомов (электронные орбитали)
внешний (n) s-подуровень
внешний (n) р-подуровень
предвнешний (n–1 ) d-подуровень
(n-2)f 1–14 (n-1)d 1–10 ns 1–2
третий снаружи (n–2) f-подуровень
Графическое изображение орбиталей
 |  |  |  |
Свойства элементов таблицы Менделеева
Металлы – элементы главных подгрупп с числом валентных электронов от 1 до 3 (подгруппы IA, IIA, IIIА, кроме элемента бора), а также германий, олово, свинец, сурьма, висмут и полоний.
Неметаллы – бор и элементы главных подгрупп с числом валентных электронов от 4 до 7 (подгруппы IVA, VA, VIA, VIIA) кроме германия, олова, свинца, сурьмы, висмута и полония.
Переходные элементы – элементы побочных подгрупп (IB-VIIB); в виде простых веществ ведут себя как металлы.
Галогены – элементы подгруппы VII(a) таблицы Менделеева, реагируют со всеми простыми веществами, кроме некот. неметаллов, являются энергичными окислителями, к ним относят F, Cl, Br, I, At, Ts.
Лантанойды – 15 элементов III группы 6-го периода, металлы с атомными номерами 57–71. Все они имеют стабильные изотопы, кроме прометия.
Актинойды – 15 радиоактивных элементов III группы 7-го периода с атомными номерами 89–103.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
В периодах с увеличением порядкового номера элемента прослеживается следующая закономерность:
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения: RH4, RH3, RH2, RH. Соединения RH4 имеют нейтральный характер; RH3 – слабоосновной; RH2 – слабокислый; RH – сильнокислый характер.
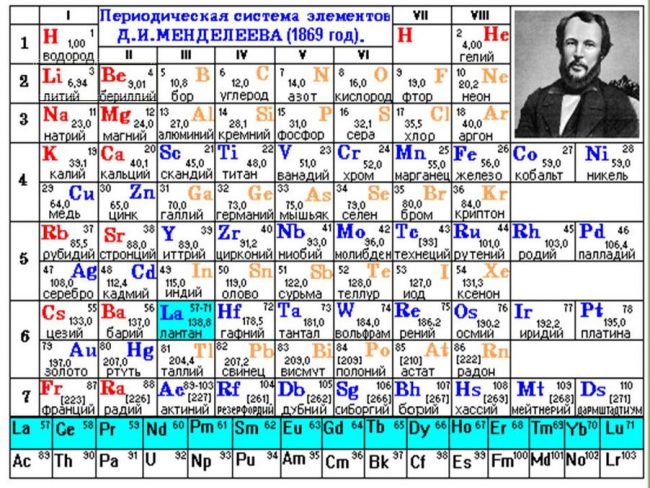
История открытия периодического закона Менделеевым Д.И.
Самый важный вклад в систематизацию химических элементов внёс русский выдающийся химик Дмитрий Иванович Менделеев, автор труда «Основы химии», который в марте 1869 года представил Русскому химическому обществу (РХО) периодический закон химических элементов, изложенный в нескольких основных положениях.
В 1871 году Менделеев в итоговой статье «Периодическая законность химических элементов» дал формулировку Периодического закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса». Тогда же Менделеев придал своей периодической таблице классический вид (короткая таблица, смотрите ниже).
В современном изложении периодический закон химических элементов звучит так: «Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).»
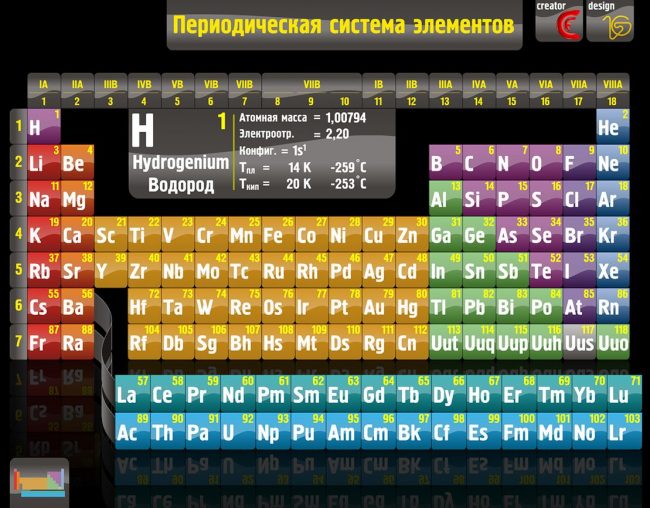
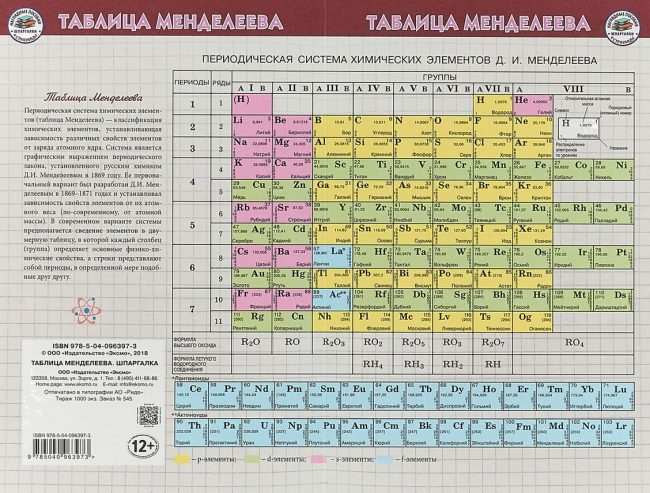
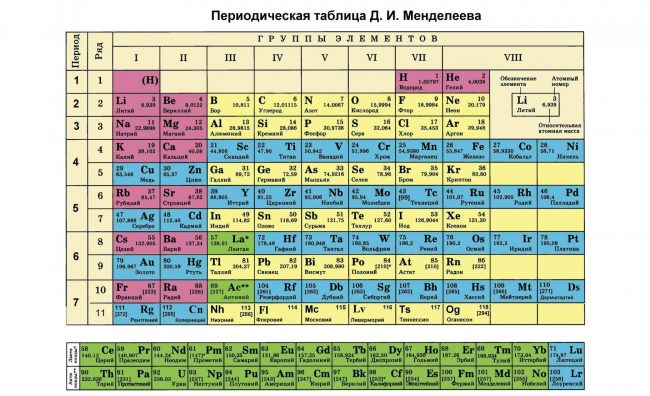
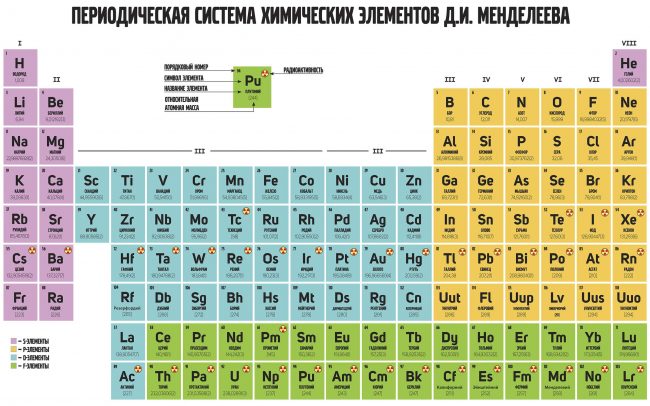
Периодическая таблица элементов Менделеева длинная форма
Длинная форма таблицы Менделеева (или длиннопериодная форма) состоит из 18 групп с лева на право от щелочных металов до благородных газов. считается официальной версией с 1989 года.
Таблица Менделеева для печати в хорошем качестве скачать
Вы можете скачать таблицу Менделеева на выбор короткую или длинную форму в цветном и черно-белом цвете, для этого откройте по ссылке ниже изображение и сохраните его себе на компьютер.
____________
Источник информации:
1. Большой химический справочник / А.И.Волков, — М.: 2005.
2. Большая энциклопедия химических элементов. Периодическая таблица Менделеева / И.А.Леенсон. — Москва : 2014.
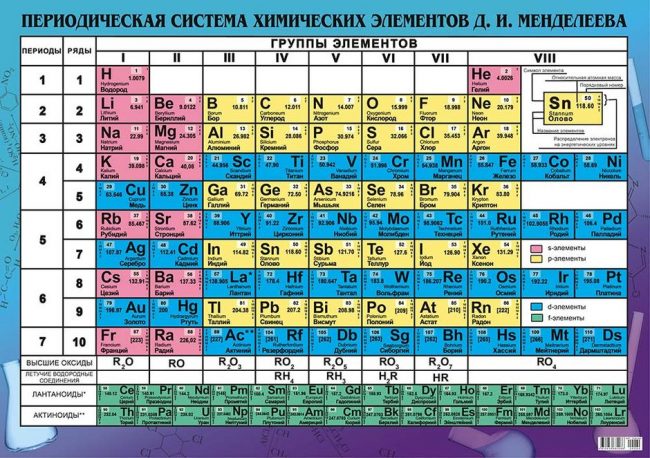
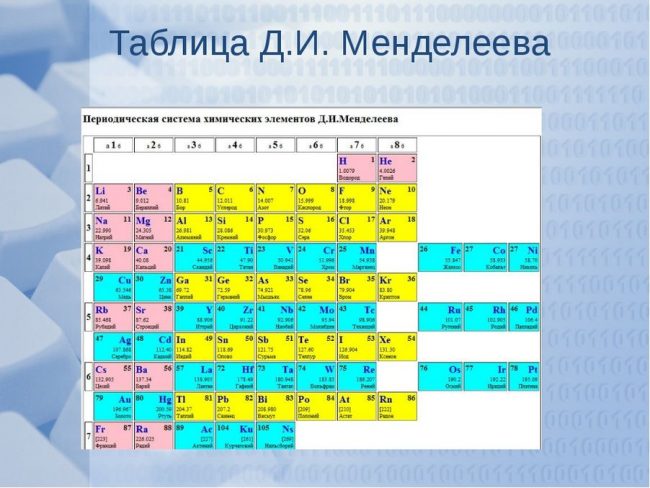
Периодическая система элементов Д. И. Менделеева
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.

Периодическая система химических элементов Д. И. Менделеева
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
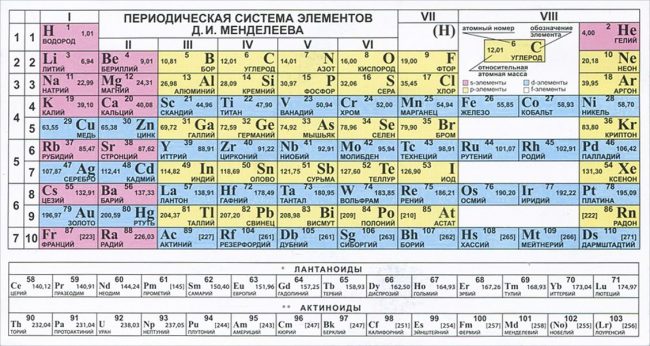
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Периодическая система химических элементов Д.И. Менделеева 2.2
Программа, написанная Феофановым Александром, представляет собой длиннопериодный вариант таблицы и содержит подробные сведения по каждому элементу, которые легко получить, наведя курсор мыши на любой из них. Приводятся название элемента на 9 языках (русский, английский, японский, немецкий, французский, испанский, китайский, греческий, арабский), электронная конфигурация, атомная масса, электроотрицательность, потенциалы ионизации, содержание в земной коре, кем и когда открыт, а также многое другое. Программа абсолютно бесплатная для некоммерческого использования. Заявлено, что программа будет работать под операционными системами Windows 98, Me, Xp, и, судя по отзывам, она также прекрасно работает и под Windows 7.
Размер программы: 693 Кб;
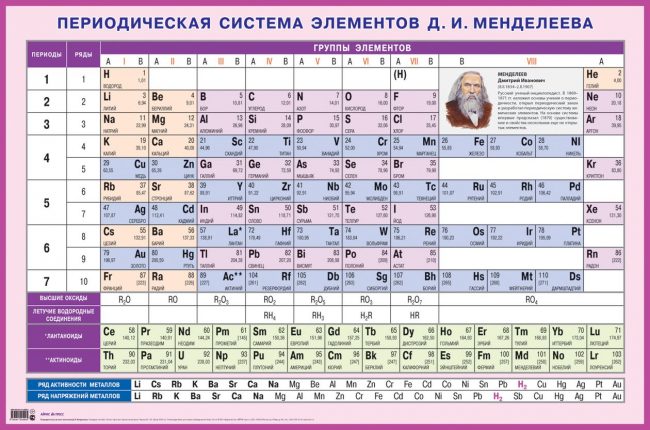
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
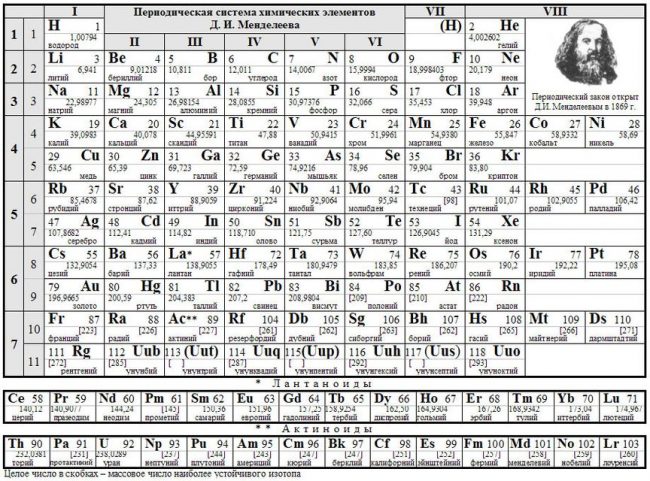
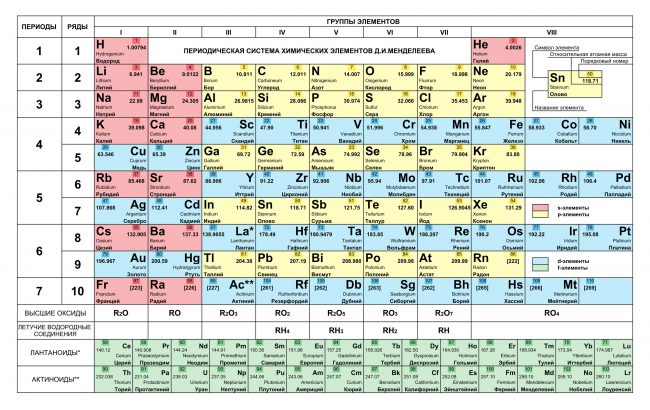
Длиннопериодный вариант (современный).
Отличный современный вариант. К сожалению качество изображения слегка ужато. Видимо автор использует оригинальную версию где-то в коммерческих целях. Подойдёт для черно-белой печати на формате А4.
Включает 114 элементов, по каждому из них вы можете видеть название элемента на русском, английском и латинском, номер, атомная масса, температуры плавления и кипения, электроотрицательность по Полингу и Аллреду, распределение электронов по энергетическим уровням;
Размер изображения: 1796х1111;
Размер — файла: 590 Кб.
Периодическая система от американского химика-коллекционера, автора книги «Сумасшедшая наука». Особенность данного издания заключается в том, что в каждой клетке элемента содержится изображение простого вещества, соответствующего ему, либо изделие из простого вещества данного элемента. В случае с трансурановыми короткоживущими элементами мы видим портрет учёного в честь которого он назван.
Включает 118 элементов с минимальной информацией: символ элемента, название, номер и внешний вид. Очень хорошо изображение подходит в качестве обоев на рабочий стол.
Размер изображения: 1173х605;
Размер файла: 239 Кб.
Вариант периодической системы в стиле нашумевшего сериала Breaking Bad (Во все тяжкие). Выполнен дизайнером Ciaran Nash. Несмотря на такой, казалось бы, минималистический дизайн, данная таблица содержит все необходимые данные о каждом элементе: символ элемента, номер, относительная атомная масса, распределение электронов по уровням. Однако, при этом таблица не содержит названий элементов так что в качестве пособия для обучения не годится.
Изображение содержит 118 элементов, даже ливерморий и флеровий на ней обозначены, в отличие от других вариантов. Неплохо подойдёт тем, кто уже неплохо знает химию, а также в качестве красивых обоев на рабочий стол.
Размер файла: 538 Кб.
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
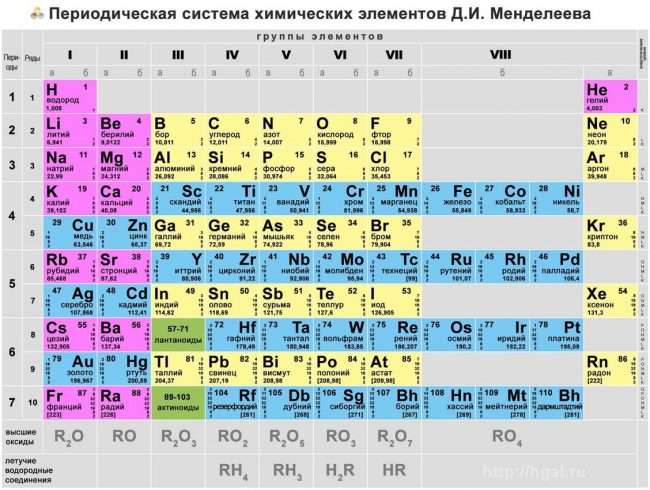
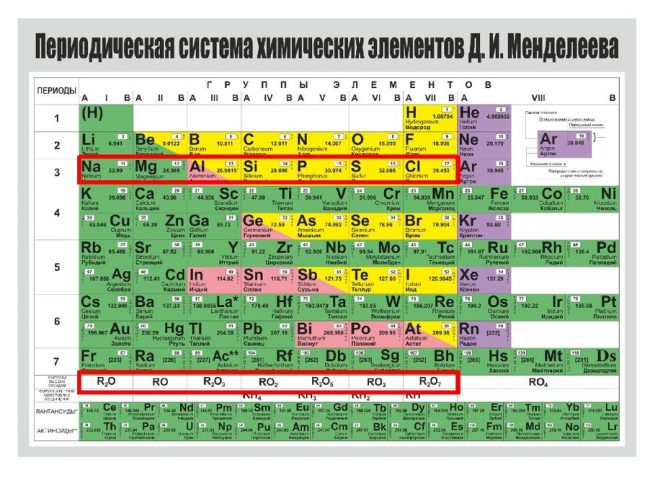
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Smell-O-Mints (для MacOs)
Для обладателей персонального компьютера с операционной системой Mac Os прекрасно подойдёт приложение Smell-O-Mints. При нажатии на любой элемент, данная программа также отображает подробные сведения о нём. Имеется возможность подсвечивания отдельных групп элементов, например по агрегатному состоянию: твёрдые, жидкие, газообразные. Имеется возможность самому группировать химические элементы по каким-либо признакам.