нитриты в моче у ребенка что делать
Бактерии в моче. Почему их не нужно лечить
Бессимптомная бактериурия — это выделение определенного количества бактерий в порции правильно собранной мочи у пациента без признаков и симптомов воспаления мочевыводящих путей.
Диагноз бессимптомной бактериурии устанавливается по результатам посева мочи — при выявлении в ней концентрации бактерий ≥10 5 в двух последовательных анализах у женщин и в одном анализе у мужчин.
Распространенность бессимптомной бактериурии у женщин увеличивается с возрастом — от 1% у школьниц до >20% у женщин старше 80 лет.
Существует взаимосвязь между наличием бактерий в моче и сексуальной активностью: например, исследования показали, что у сексуально активных женщин распространенность бессимптомной бактериурии выше, чем у монахинь того же возраста.
При этом у молодых здоровых женщин бессимптомная бактериурия редко длится дольше нескольких недель.
В норме моча стерильна, однако при определенных условиях может быть хорошей средой для размножения бактерий, например, при сахарном диабете.
Наличие в общем анализе мочи бактерий не говорит об обязательном высевании какой-либо бактерии при бактериологическом анализе (при посеве мочи). Точно так же повышенное количество лейкоцитов не всегда свидетельствует о наличии бактерий в моче.
У мужчин бессимптомная бактериурия встречается редко. Выявление бактерий в моче возможно у 6-15% пожилых мужчин старше 75 лет. При наличии бессимптомной бактериурии у молодых мужчин рекомендовано дообследование с целью исключения бактериального простатита.
Лечить бессимптомную бактериурию не надо.
Лечение бессимптомной бактериурии не требуется, потому что:
Лечение бессимптомной бактериурии показано у небольшой группы пациентов:
С беременными не все однозначно. По статистике, 2-10% беременных женщин ставят диагноз бессимптомная бактериурия. Часто, при наличии бактерий в общем анализе мочи или наличии бактерий в низком титре (например, 10³), женщине сходу назначается антибиотик, который, скорее всего, совсем не нужен.
Дело в том, что большинство исследований по диагностике и лечению бессимптомной бактериурии у беременных относится к 70-80-м годам прошлого века. По их результатам у 20-30% беременных с ББ развивается острый пиелонефрит, который сопряжен с невынашиванием беременности, низкой массой плода и другими неблагоприятными факторами. Но за прошедшие десятилетия изменились многие факторы, и современные исследования (правда, немногочисленные) показывают низкий риск развития пиелонефрита у беременных женщин с бессимптомной бактериурией — около 3%!
В официальном гайдлайне Европейской ассоциации урологов и в российских рекомендациях указано, что лечить бессимптомную бактериурию у беременных необходимо. Возможно, с ростом качественных исследований по этой теме рекомендации поменяются. А пока показаны короткие курсы антибактериальной терапии для уменьшения частоты побочных эффектов. Возможно использование фосфомицина (Монурал) или антибиотика пенициллинового либо цефалоспоринового ряда (Амоксиклав, Супракс).
Общий анализ мочи (с микроскопией осадка)
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Общий анализ мочи (с микроскопией осадка): показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показания для назначения исследования
Общий анализ мочи относится к рутинным лабораторным исследованиям, направленным в первую очередь на скрининг заболеваний органов мочевыделительной системы, поскольку патологические процессы в почках и мочевыводящих путях влияют на свойства мочи.
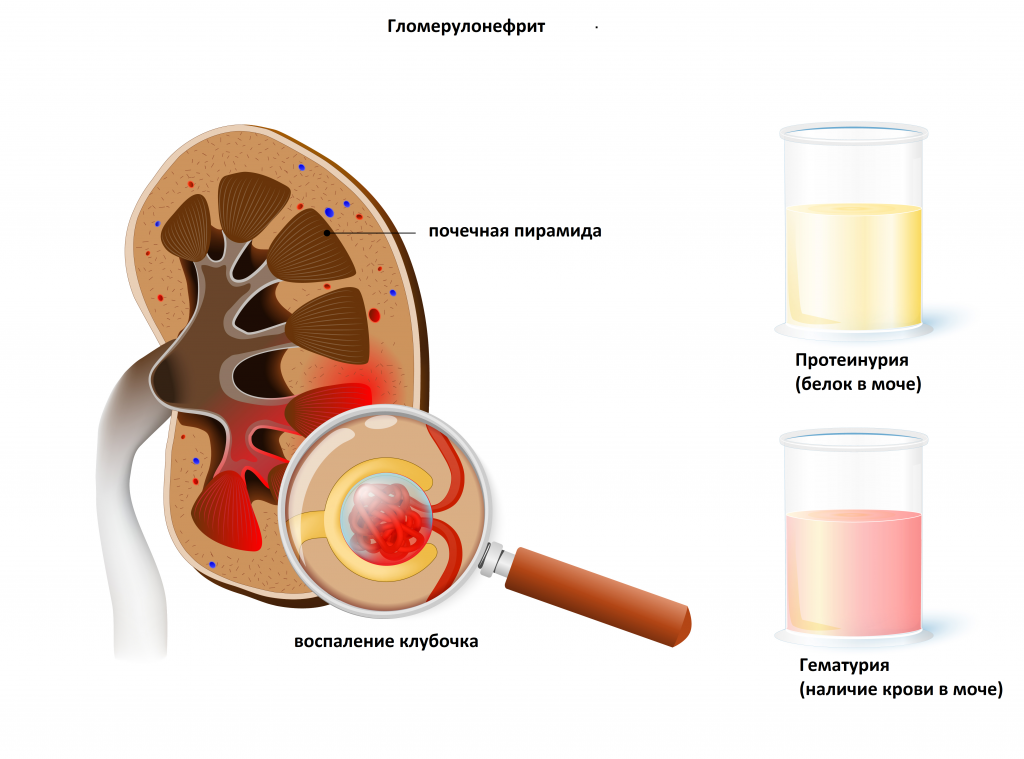
С помощью этого простого диагностического теста можно выявить заболевания инфекционно-воспалительного характера, такие как гломерулонефрит (воспаление почечных клубочков), пиелонефрит (воспаление почечных лоханок), цистит (воспаление мочевого пузыря).
Микроскопия осадка мочи позволяет заподозрить травму или инфаркт почки, мочекаменную болезнь, некоторые новообразования, амилоидоз почек (системное заболевание, при котором в почках откладывается специфический нерастворимый белок, из-за чего нарушается функционирование органа).
Помимо диагностики заболеваний почек и мочевыводящих путей, по результатам общего анализа мочи с микроскопией осадка можно получить сведения об общем состоянии здоровья.
Моча образуется в результате ультрафильтрации плазмы крови через клубочки почек. При развитии различных заболеваний в кровь поступают патологические продукты обмена веществ, которые выводятся из организма, в том числе через почки.
Подготовка к процедуре
Подготовка к общему анализу мочи начинается за день до сбора биоматериала. Некоторые продукты питания, объем выпитой жидкости, прием лекарственных препаратов и биодобавок, интенсивные физические нагрузки могут исказить результаты исследования.
За день до сбора мочи необходимо отказаться от продуктов, которые могут повлиять на цвет мочи: например, свекла и черника придают моче красноватый оттенок, при употреблении большого количества моркови или добавок с каротином цвет мочи может измениться на оранжевый.
Накануне сбора мочи не рекомендуется прием алкоголя, кофе, биодобавок и крепкого чая. По возможности следует ограничить прием диуретических (мочегонных) средств. Требуется исключить серьезные физические нагрузки, а также посещение бани, сауны.
Женщинам во время менструаций не рекомендуется сдавать мочу на исследование, поскольку даже небольшое количество крови значительно исказит результат анализа.
Следует предупредить врача о принимаемых лекарственных препаратах, а также о проведении инвазивных обследований (например, цистоскопии) накануне исследования.
Методика сбора мочи для общего анализа
Исследование мочи включает в себя изучение физических и химических свойств, а также микроскопию осадка.
Физические свойства: количество, цвет, запах, прозрачность, относительная плотность (удельный вес), реакция мочи (pH).
Химические свойства: определение белка, глюкозы, кетоновых тел, уробилиногена, билирубина, гемоглобина, нитритов, лейкоцитарной эстеразы.
Микроскопия: выявление эритроцитов, лейкоцитов, клеток плоского, переходного и почечного эпителия, цилиндров, кристаллов, слизи, бактерий, грибков.
| Показатель | Результат |
| Количество | 50 мл |
| Цвет | Бесцветная, светло-желтая, соломенно-желтая, желтая, янтарно-желтая |
| Запах | Без запаха или неспецифичный |
| Прозрачность | Прозрачная |
| Относительная плотность мочи (удельный вес) | 1003-1035 |
| Реакция мочи (pH) | 5,0-8,0 (у детей до 1 мес. – 5,0-7,0) |
| Белок | > 0,140 г/л |
| Глюкоза | > 2,8 ммоль/л |
| Кетоновые тела | > 1 ммоль/л |
| Уробилиноген | > 34 ммоль/л |
| Билирубин | Не обнаруживается |
| Гемоглобин | Не обнаруживается |
| Лейкоцитарная эстераза | Не обнаруживается |
| Нитриты | Не обнаруживаются |
| Эритроциты | До 2 клеток в поле зрения |
| Лейкоциты | До 5 клеток в поле зрения |
| Эпителий | До 5 клеток плоского эпителия в поле зрения |
| Цилиндры | Не обнаруживаются |
| Кристаллы | Небольшое количество уратов, оксалатов кальция, аморфных фосфатов или не обнаруживаются |
| Слизь | В небольшом количестве |
| Бактерии | Не обнаруживаются |
| Грибки | Не обнаруживаются |
Расшифровка показателей
Следует помнить, что общий анализ мочи является скрининговым исследованием, поэтому его результаты можно использовать при назначении других лабораторных и инструментальных обследований для уточнения диагноза.
Цвет мочи зависит от концентрации растворенных в ней веществ и колеблется от прозрачного до янтарно-желтого.

В нормальных условиях окраску моче придают продукты пигментного обмена (в частности, билирубина): урохромы, уробилиноиды и другие вещества. При повышении уровня билирубина в крови он в большем количестве поступает в мочу и придает ей насыщенный коричневатый или даже зеленовато-бурый цвет. При попадании эритроцитов (красных кровяных телец), миоглобина (основного белка мышечной ткани) или гемоглобина (белка, содержащегося в эритроцитах) в мочу ее цвет меняется на буро-красный и приобретает вид «мясных помоев». Прием витаминов и препаратов нитрофуранового ряда может придать моче цвет от лимонно-желтого до оранжевого. При большом количестве лейкоцитов (белых кровяных телец) моча становится молочного цвета (это состояние называется пиурия).
Прозрачность. В обычных условиях моча прозрачна. Ее помутнение может быть вызвано наличием солей, кристаллов, клеточных элементов (эритроцитов, лейкоцитов).
Запах. В норме моча имеет слабый неспецифичный запах. Появление аммиачного запаха может быть признаком бактериальной инфекции, своеобразный фруктовый запах («гниющих яблок») появляется при увеличении концентрации кетоновых тел (что чаще всего указывает на сахарный диабет – нарушение обмена глюкозы).
Относительная плотность мочи, или удельный вес, определяется с помощью урометра. Относительная плотность мочи дает представление о концентрационной способности почек и о функции разведения, которые снижаются, как и относительная плотность мочи, при почечной недостаточности.
Реакция мочи (pH) – водородный показатель, отражающий способность почек поддерживать кислотно-основной баланс организма. Почки участвуют в выведении ионов водорода и бикарбонатов, сохраняя постоянство pH крови. На значение рН мочи большое влияние оказывают диета, особенности метаболизма, инфекционно-воспалительные процессы в почках и мочевыводящих путях.
Белок в моче выступает значимым маркером в диагностике заболеваний почек, мочевыводящих путей и сердечно-сосудистой системы, также он важен в диагностике гестоза – тяжелого осложнения беременности. Появление белка в моче называется протеинурия. В норме моча не содержит белка, поскольку почечный фильтр мешает выходу белковых молекул из крови в мочу. Выделяют несколько причин протеинурии.
Появление глюкозы в моче служит сигналом, указывающим на патологию почек, эндокринной системы, побочное действие лекарств, отравления, осложненное течение беременности.
Кетоновые тела являются неспецифичным показателем. Появление повышенного количества кетоновых тел в моче – результат ускоренного жирового обмена или пониженного метаболизма углеводов. Наиболее часто повышение их уровня отмечается при голодании, лихорадке, рвоте, алкогольной интоксикации и сахарном диабете.
Уробилиноген в моче возрастает при заболеваниях кишечника, печени, при гемолитических состояниях (разрушении эритроцитов).
Билирубин появляется в моче при патологиях печени, инфекционных заболеваниях и нарушениях пигментного обмена.
Гемоглобин определяется при большом количестве эритроцитов в моче, при миозитах, обширных травмах мышечной ткани, тромбозах сосудов мышц.
Нитриты в моче выявляют при активации патогенной микрофлоры в мочевыводящей системе.
Повышение количества эритроцитов наблюдается в следующих случаях:
Цилиндры образуются в канальцах почек и позволяют определить уровень их поражения. Чаще всего встречаются при гломерулонефритах.
Кристаллы выявляются в осадке солей при определенном pH мочи. Наиболее часто (хотя не всегда) встречаются у пациентов с мочекаменной болезнью.
Слизь в норме может встречаться в мочевом осадке в небольшом количестве. Повышение содержания слизи может быть связано как с воспалительным процессом в мочевыводящих путях, так и с погрешностями, допущенными при сборе мочи для исследования.
Бактерии и грибки в норме в мочевом осадке не обнаруживаются. Их присутствие свидетельствует о наличии инфекционного процесса в почках и мочевыводящих путях или о погрешностях, допущенных при сборе биоматериала для исследования.
При отклонении от нормы показателей общего анализа мочи дополнительно могут быть назначены следующие инструментальные обследования и лабораторные тесты:
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Антибиотики в лечении и профилактике инфекций мочевыводящих путей у детей
Инфекция мочевыводящих путей (ИМП) — рост микроорганизмов в различных отделах почек и мочевыводящих путей (МП), способный вызвать воспалительный процесс, по локализации соответствующий заболеванию (пиелонефриту, циститу, уретриту и т. д.). ИМП детей
Инфекция мочевыводящих путей (ИМП) — рост микроорганизмов в различных отделах почек и мочевыводящих путей (МП), способный вызвать воспалительный процесс, по локализации соответствующий заболеванию (пиелонефриту, циститу, уретриту и т. д.).
ИМП детей встречается в России с частотой около 1000 случаев на 100 000 населения. Довольно часто ИМП имеют тенденцию к хроническому, рецидивирующему течению. Это объясняется особенностью строения, кровообращения, иннервации МП и возрастной дисфункцией иммунной системы растущего организма ребенка. В связи с этим принято выделять ряд факторов, способствующих развитию ИМП:
В детском возрасте ИМП в 80% случаев развиваются на фоне врожденных аномалий верхних и нижних МП, при которых имеются нарушения уродинамики. В таких случаях говорят об осложненной ИМП. При неосложненной форме анатомических нарушений и расстройств уродинамики не определяется.
Среди наиболее часто встречающихся пороков развития мочевого тракта пузырно-мочеточниковый рефлюкс встречается в 30–40% случаев. Второе место занимает мегауретер, нейрогенная дисфункция мочевого пузыря. При гидронефрозе инфицирование почки происходит реже.
Диагностика ИМП строится на многих принципах. Необходимо помнить, что симптоматика ИМП зависит от возраста ребенка. Например, у новорожденных детей отсутствуют специфические симптомы ИМП и инфекция редко генерализуется.
Для детей младшего возраста характерны такие симптомы, как вялость, беспокойство, периодические подъемы температуры, анорексия, рвота и желтуха.
Для детей старшего возраста характерны лихорадка, боли в спине, животе и дизурические явления.
Перечень вопросов при сборе анамнеза включает следующие пункты:
Врач всегда должен стремиться более точно установить локализацию возможного очага инфекции: от этого зависит вид лечения и прогноз заболевания. Для уточнения топики поражения мочевого тракта необходимо хорошо знать клиническую симптоматику инфекций нижних и верхних мочевых путей. При инфекции верхних мочевыводящих путей значимым является пиелонефрит, который составляет до 60% всех случаев госпитализации детей в стационар (таблица).
Однако основу диагностики ИМП составляют данные анализов мочи, в которых главное значение имеют микробиологические методы. Выделение микроорганизма в посеве мочи служит основанием для постановки диагноза. Существует несколько способов забора мочи:
Распространенным непрямым методом оценки бактериурии является анализ на нитриты (нитраты, в норме имеющиеся в моче, при наличии бактерий преобразуются в нитриты). Диагностическая ценность данного метода достигает 99%, но у маленьких детей в связи с коротким пребыванием мочи в мочевом пузыре значительно снижена и достигает 30–50%. Необходимо помнить, что у маленьких мальчиков может быть ложноположительный результат из-за аккумуляции нитритов в препуциальном мешке.
В большинстве случаев ИМП вызывается одним видом микроорганизма. Определение в образцах нескольких видов бактерий чаще всего объясняется нарушениями техники сбора и транспортировки материала.
При хроническом течении ИМП в некоторых случаях возможно выявление микробных ассоциаций.
К другим методам исследования мочи относятся сбор общего анализа мочи, проба Нечипоренко и Аддиса–Каковского. Лейкоцитурия наблюдается во всех случаях ИМП, однако необходимо помнить, что она может быть, например, и при вульвите. Макрогематурия встречается у 20–25% детей с циститом. При наличии симптомов инфекции протеинурия подтверждает диагноз пиелонефрита.
Инструментальные обследования проводятся детям в период ремиссии процесса. Целью их является уточнение локализации инфекции, причины и степени повреждения почек. Обследование детей с ИМП на сегодняшний день включает:
Проведение инструментального и рентгенологического обследования должно выполняться по следующим показаниям:
Бактериальная этиология ИМС при урологических заболеваниях имеет отличительные особенности в зависимости от остроты процесса, частоты осложненных форм, возраста пациента и состояния его иммунного статуса, условий возникновения инфекции (амбулаторно или в стационаре).
Результаты исследований (данные НЦЗД РАМН, 2005) показывают, что у амбулаторных больных с ИМП в 50% случаев выделяются E. coli, в 10% — Proteus spp., в 13% — Klebsiella spp., в 3% — Enterobacter spp., в 2% — Morganella morg. и с частотой 11% — Enterococcus fac. (рисунок). Другие микроорганизмы, составившие 7% выделения и встречавшиеся с частотой менее 1%, были следующими: S. epidermidis — 0,8%, S. pneumoniae — 0,6%, Acinetobacter spp. — 0,6%, Citrobacter spp. — 0,3%, S. pyogenes — 0,3%, Serratia spp. — 0,3%.
В структуре внутрибольничных инфекций ИМП занимают второе место, после инфекций дыхательных путей. Следует отметить, что у 5% детей, находящихся в урологическом стационаре, развиваются инфекционные осложнения, обусловленные хирургическим или диагностическим вмешательством.
У стационарных больных этиологическая значимость кишечной палочки значительно снижается (до 29%) за счет увеличения и/или присоединения таких «проблемных» возбудителей, как Pseudomonas aeruginosa (29%), Enterococcus faec. (4%), коагулазонегативные стафилококки (2,6%), неферментирующие грамотрицательные бактерии (Acinetobacter spp. — 1,6%, Stenotrophomonas maltophilia — 1,2%) и др. Чувствительность этих возбудителей к антибактериальным препаратам часто непредсказуема, так как зависит от ряда факторов, в том числе и от особенностей циркулирующих в данном стационаре внутрибольничных штаммов.
Не вызывает сомнений, что основными задачами в лечении больных с ИМП являются ликвидация или уменьшение воспалительного процесса в почечной ткани и МП, при этом успех лечения во многом определяется рациональной антимикробной терапией.
Естественно, при выборе препарата уролог руководствуется прежде всего сведениями о возбудителе инфекции и о спектре антимикробного действия препарата. Антибиотик может быть безопасным, способным создавать высокие концентрации в паренхиме почек и моче, но если в его спектре нет активности против конкретного возбудителя, назначение такого препарата бессмысленно.
Глобальной проблемой в назначении антибактериальных препаратов является рост резистентности микроорганизмов к ним. Причем наиболее часто резистентность развивается у внебольничных и нозокомиальных больных. Те микроорганизмы, которые не входят в антибактериальный спектр какого-либо антибиотика, естественно, считаются резистентными. Приобретенная же резистентность означает, что изначально чувствительный к определенному антибиотику микроорганизм становится устойчивым к его действию.
На практике часто заблуждаются в отношении приобретенной резистентности, считая, что ее возникновение неизбежно. Но наука располагает фактами, опровергающими такое мнение. Клиническое значение этих фактов состоит в том, что антибиотики, которые не вызывают резистентности, можно использовать, не опасаясь ее последующего развития. Но если же развитие резистентности потенциально возможно, то и появляется она достаточно быстро. Другое заблуждение заключается в том, что развитие резистентности связывают с использованием антибиотиков в больших объемах. Примеры с наиболее часто назначаемым в мире антибиотиком цефтриаксоном, а также с цефокситином и цефуроксимом поддерживают концепцию о том, что использование антибиотиков с низким потенциалом развития резистентности в любых объемах не приведет к ее росту в последующем.
Многие считают, что для одних классов антибиотиков возникновение антибиотикорезистентности характерно (это мнение относится к цефалоспоринам III поколения), а для других — нет. Однако развитие резистентности связано не с классом антибиотика, а с конкретным препаратом.
Если антибиотик обладает потенциалом развития резистентности, признаки резистентности к нему появляются уже в течение первых 2 лет применения или даже на этапе клинических испытаний. Исходя из этого, мы можем с уверенностью прогнозировать проблемы резистентности: среди аминогликозидов — это гентамицин, среди цефалоспоринов II поколения — цефамандол, III поколения — цефтазидим, среди фторхинолонов — тровофлоксацин, среди карбапенемов — имипенем. Внедрение в практику имипенема сопровождалось быстрым развитием резистентности к нему штаммов P. aeruginosa, этот процесс продолжается и сейчас (появление меропенема не было сопряжено с такой проблемой, и можно утверждать, что она не возникнет и в ближайшем будущем). Среди гликопептидов — это ванкомицин.
Как уже указывалось, у 5% больных, находящихся в стационаре, развиваются инфекционные осложнения. Отсюда и тяжесть состояния, и увеличение сроков выздоровления, пребывания на койке, повышение стоимости лечения. В структуре внутрибольничных инфекций ИМП занимают первое место, на втором месте — хирургические (раневые инфекции кожи и мягких тканей, абдоминальные).
Сложности лечения госпитальных инфекций обусловлены тяжестью состояния больного. Часто имеет место ассоциация возбудителей (два и более, при раневой или катетер-ассоциированной инфекции). Также большое значение имеет возросшая в последние годы резистентность микроорганизмов к традиционным антибактериальным препаратам (к пенициллинам, цефалоспоринам, аминогликозидам), применяемым при инфекции мочеполовой системы.
На сегодняшний день чувствительность госпитальных штаммов Enterobacter spp. к Амоксиклаву (амоксициллин + клавулановая кислота) составляет 40%, к цефуроксиму — 30%, к гентамицину — 50%, чувствительность S. aureus к оксациллину составляет 67%, к линкомицину — 56%, к ципрофлоксацину — 50%, к гентамицину — 50%. Чувствительность штаммов P. aeruginosa к цефтазидиму в разных отделениях не превышает 80%, к гентамицину — 50%.
Существуют два потенциальных подхода к преодолению резистентности к антибиотикам. Первый заключается в профилактике резистентности, например путем ограничения применения антибиотиков, обладающих высоким потенциалом ее развития; столь же важными являются эффективные программы эпидемиологического контроля для предотвращения распространения в лечебном учреждении госпитальных инфекций, вызываемых высокорезистентными микроорганизмами (стационарный мониторинг). Второй подход — устранение или коррекция уже имеющихся проблем. Например, если в отделении интенсивной терапии (или в стационаре вообще) распространены резистентные штаммы P. aeruginosa или Enterobacter spp., то полная замена в формулярах антибиотиков с высоким потенциалом развития резистентности на антибиотики-«чистильщики» (амикацин вместо гентамицина, меропенем вместо имипенема и т.п.) позволит устранить или минимизировать антибиотикорезистентность грамотрицательных аэробных микроорганизмов.
В лечении ИМП на сегодняшний день используются: ингибиторозащищенные пенициллины, цефалоспорины, аминогликозиды, карбапенемы, фторхинолоны (ограничены в педиатрии), уроантисептики (производные нитрофурана — Фурагин).
Остановимся на антибактериальных препаратах в лечении ИМП подробнее.
Рекомендуемые препараты при инфекции нижних мочевых путей.
При инфекции верхних мочевых путей.
При госпитальной инфекции.
Для периоперационной антибактериальной профилактики.
Для антибактериальной профилактики при инвазивных манипуляциях: ингибиторозащищенные аминопенициллины — амоксициллин + клавулановая кислота.
Принято считать, что антибактериальная терапия амбулаторных больных с ИМП может проводиться эмпирически, основываясь на данных антибиотикочувствительности основных уропатогенов, циркулирующих в конкретном регионе в данный период наблюдения, и клиническом статусе пациента.
Стратегическим принципом антибиотикотерапии в амбулаторных условиях является принцип минимальной достаточности. Препаратами первого ряда служат:
Ошибочным является использование в амбулаторных условиях ампициллина и ко-тримоксазола, в связи с возросшей резистентностью к ним E. coli. Неоправданно назначение цефалоспоринов I поколения (цефалексин, цефрадин, цефазолин). Производные нитрофуранового ряда (Фурагин) не создают терапевтических концентраций в почечной паренхиме, поэтому их назначают только при цистите. В целях снижения роста резистентности микроорганизмов следует резко ограничить применение цефалоспоринов III поколения и полностью исключить назначение аминогликозидов в амбулаторной практике.
Анализ резистентности штаммов возбудителей осложненных уроинфекций показывает, что активность препаратов группы полусинтетических пенициллинов и защищенных пенициллинов может быть достаточно высокой в отношении кишечной палочки и протеев, однако в отношении энтеробактерий и синегнойной палочки их активность составляет до 42 и 39% соответственно. Поэтому препараты этой группы не могут быть препаратами эмпирической терапии тяжелых гнойно-воспалительных процессов органов мочевыделения.
Активность цефалоспоринов I и II поколений в отношении энтеробактера и протеев также оказывается очень низкой и колеблется в пределах 15–24%, в отношении кишечной палочки — несколько выше, однако не превышает активности полусинтетических пенициллинов.
Активность цефалоспоринов III и IV поколений существенно выше, чем у пенициллинов и цефалоспоринов I и II поколений. Наиболее высокая активность отмечена в отношении кишечной палочки — от 67 (цефоперазон) до 91% (цефепим). В отношении энтеробактера активность составляет от 51 (цефтриаксон) до 70% (цефепим), также высокая активность препаратов этой группы отмечается в отношении протеев (65–69%). В отношении синегнойной палочки активность этой группы препаратов низкая (15% у цефтриаксона, 62% у цефепима). Спектр антибактериальной активности цефтазидима наиболее высокий в отношении всех актуальных грамотрицательных возбудителей осложненных инфекций (от 80 до 99%). Высокой сохраняется активность карбапенемов — от 84 до 100% (у имипенема).
Активность аминогликозидов несколько ниже, особенно в отношении энтерококков, но в отношении энтеробактерий и протея высокая активность сохраняется у амикацина.
По этой причине антибактериальная терапия ИМП у урологических больных в стационаре должна основываться на данных микробиологической диагностики возбудителя инфекции у каждого больного и его чувствительности к антибактериальным препаратам. Начальная эмпирическая антимикробная терапия урологических больных может назначаться только до получения результатов бактериологического исследования, после которого она должна быть изменена согласно антибиотикочувствительности выделенного микроорганизма.
В применении антибиотикотерапии в стационаре следует придерживаться другого принципа — от простого к мощному (минимум использования, максимум интенсивности). Спектр используемых групп антибактериальных препаратов здесь значительно расширен:
Важной в работе детского уролога является периоперационная антибиотикопрофилактика (пре-, интра- и постоперационная). Конечно, не следует пренебрегать влиянием других факторов, снижающих вероятность развития инфекции (сокращение сроков пребывания в стационаре, качество обработки инструментария, катетеров, использование закрытых систем для отведения мочи, обучение персонала).
Основные исследования показывают, что послеоперационные осложнения предотвращаются в том случае, если высокая концентрация антибактериального препарата в сыворотке крови (и в тканях) создана к началу оперативного вмешательства. В клинической практике оптимальное время для антибиотикопрофилактики — 30–60 мин до начала операции (при условии внутривенного введения антибиотика), т. е. в начале анестезиологических мероприятий. Отмечен значительный рост частоты возникновения послеоперационных инфекций, если профилактическая доза антибиотика была назначена не в пределах 1 ч до проведения операции. Любой антибактериальный препарат, введенный после закрытия операционной раны, не повлияет на вероятность развития осложнений.
Таким образом, однократное введение адекватного антибактериального препарата в целях профилактики не менее эффективно, чем многократное. Только при длительном оперативном вмешательстве (более 3 ч) требуется дополнительная доза. Антибиотикопрофилактика не может продолжаться более 24 ч, так как в этом случае применение антибиотика рассматривается уже как терапия, а не как профилактика.
Идеальный антибиотик, в том числе и для периоперационной профилактики, должен быть высокоэффективен, хорошо переноситься больными, обладать невысокой токсичностью. Его антибактериальный спектр должен включать вероятную микрофлору. Для пациентов, длительно находящихся в стационаре до проведения оперативного вмешательства, необходимо принимать во внимание спектр нозокомиальных микроорганизмов с учетом их антибиотикочувствительности.
Для антибиотикопрофилактики при урологических операциях желательно использовать препараты, создающие высокую концентрацию в моче. Многие антибиотики отвечают этим требованиям и могут использоваться, например цефалоспорины II поколения и ингибиторозащищенные пенициллины. Аминогликозиды должны быть зарезервированы для пациентов, входящих в группы риска или с аллергией на b-лактамы. Цефалоспорины III и IV поколений, ингибиторозащищенные аминопенициллины и карбапенемы должны использоваться в единичных случаях, когда место операции обсеменено мультирезистентными нозокомиальными микроорганизмами. Все-таки желательно, чтобы назначение этих препаратов было ограничено лечением инфекций с тяжелым клиническим течением.
Существуют общие принципы антибактериальной терапии ИМП у детей, которые включают в себя следующие правила.
При фебрильном течении ИМП начинать терапию следует с парентерального антибиотика широкого спектра (ингибиторозащищенные пенициллины, цефалоспорины II, III поколений, аминогликозиды).
Необходимо учитывать чувствительность микрофлоры мочи.
Длительность лечения пиелонефрита составляет 14 дней, цистита — 7 дней.
У детей с пузырно-мочеточниковым рефлюксом антимикробная профилактика должна быть длительной.
При бессимптомной бактериурии антибактериальная терапия не показана.
В понятие «рациональная антибиотикотерапия» должен входить не только правильный выбор препарата, но и выбор его введения. Необходимо стремиться к щадящим и в то же время наиболее эффективным методам назначения антибактериальных препаратов. При использовании ступенчатой терапии, которая заключается в смене парентерального использования антибиотика на пероральный, после нормализации температуры, врач должен помнить о следующем.
Ниже представлены антибактериальные препараты в зависимости от пути их введения.
Препараты для перорального лечения ИМП.
• II поколения: цефуроксим;
• III поколения: цефиксим, цефтибутен, цефподоксим.
Препараты для парентерального лечения ИМП.
• II поколения: цефуроксим (Цефурабол).
• III поколения: цефотаксим, цефтриаксон, цефтазидим.
• IV поколения: цефепим (Максипим).
Несмотря на наличие современных антибиотиков и химиотерапевтических препаратов, позволяющих быстро и эффективно справляться с инфекцией и уменьшать частоту рецидивов путем назначения на длительный период препаратов в низких профилактических дозах, лечение рецидивов ИМП все еще представляет собой довольно сложную задачу. Это обусловлено:
Как известно, до 30% девочек имеют рецидив ИМП в течение 1 года, 50% — в течение 5 лет. У мальчиков до 1 года рецидивы встречаются в 15–20%, старше 1 года — рецидивов меньше.
Перечислим показания к антибиотикопрофилактике.
а) пузырно-мочеточниковый рефлюкс;
Длительность антибиотикопрофилактики чаще всего определяется индивидуально. Отмена препарата осуществляется при отсутствии обострений за время профилактики, но при возникновении обострения после отмены требуется назначение нового курса.
В последнее время на отечественном рынке появился новый препарат для профилактики рецидивов ИМП. Этот препарат представляет собой лиофилизированный белковый экстракт, полученный путем фракционирования щелочного гидролизата некоторых штаммов E. coli и носит название Уро-Ваксом. Проведенные испытания подтвердили его высокую эффективность с отсутствием выраженных побочных явлений, что возлагает надежду на его широкое использование.
Важное место в лечении больных с ИМП занимает диспансерное наблюдение, которое заключается в следующем.
Литература
С. Н. Зоркин, доктор медицинских наук, профессор
НЦЗД РАМН, Москва
